Un nouvel ‘envahisseur’ dans les lagunes méditerranéennes françaises !
Date de publication : 03/11/2014
Auteurs : Floriane Delpy1, Séverine Albouy-Boyer2, Delphine Bonnet2
Depuis plusieurs décennies, une augmentation des proliférations du zooplancton gélatineux semble être observée à travers le monde, que ce soit en termes d’intensité ou de fréquence, causant de nombreuses perturbations aux activités humaines (tourisme, pêcheries, centrale électrique …) (Purcell et al. 2007).
Ces phénomènes sont de plus en plus médiatisés avec le développement des recherches en océanographie et des moyens de communication (Condon et al. 2012). La capacité à proliférer de ces organismes est en effet spectaculaire avec un taux de reproduction particulièrement élevé, un taux de croissance très rapide et d’importantes capacités de régénération.
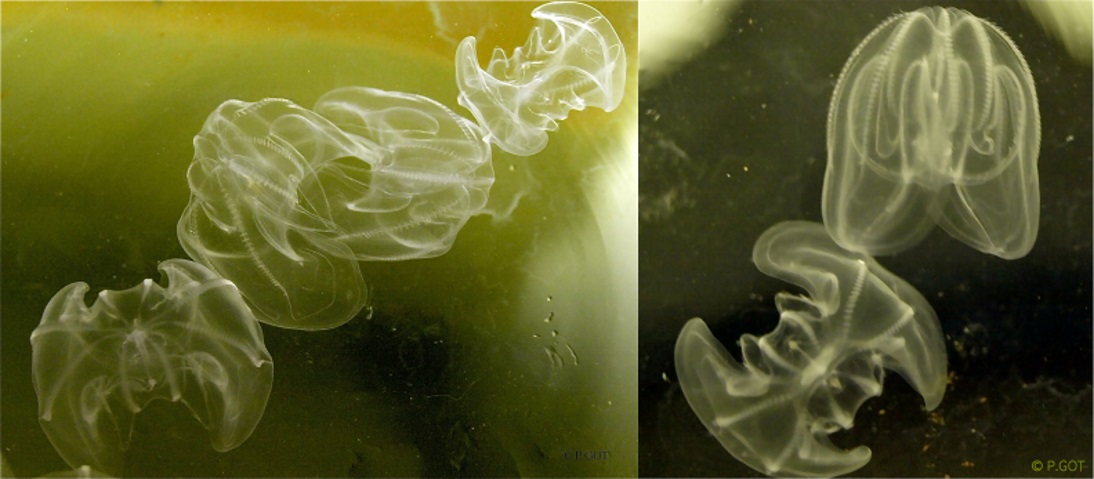
Ces phénomènes sont d’autant plus abondants avec l’introduction d’espèces invasives telles que le cténophore Mnemiopsis leidyi (Figure 1) originaire de la côte Est du continent américain (40°N – 46°S). Depuis son introduction en Mer Noire dans les années 1980 (Vinogradov et al. 1989), sa distribution géographique ne cesse de s’étendre aussi bien en Europe du Nord qu’en Mer Méditerranée.
Mnemiopsis est ainsi régulièrement présent dans certaines lagunes méditerranéennes françaises depuis 2005. Des analyses génétiques ont révélé que cette espèce a été introduite en Europe à partir de deux régions différentes (Reusch et al. 2010). Alors que la population observée au Nord est proche de celle native du Nord-Est des États-Unis, l’introduction au Sud correspond à deux événements distincts. Mnemiopsis a d’abord été amené en Mer Noire probablement par des eaux de ballast dans les années 1980, puis il s’est propagé en Mer Méditerranée dans un second temps.
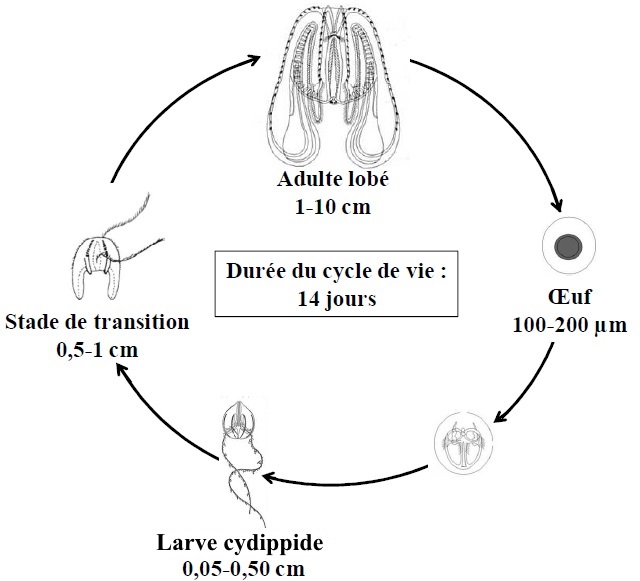
Cette espèce possède un fort potentiel invasif avec une grande capacité d’adaptation. Il peut supporter des températures comprises entre 0 et 32°C, ainsi que des salinités entre 2 et 45 (Kremer 1994). Mnemiopsis est également un redoutable prédateur qui consomme des proies allant du microplancton (50 µm) aux larves de poissons (> 3 mm) en filtrant de large volume d’eau (Colin et al. 2010). Cet organisme hermaphrodite est capable de produire par fécondation externe jusqu’à 14 000 œufs tous les 10 à 20 jours (Jaspers et al. 2011). Les œufs se développent en une larve cydippide tentaculée, puis en un stade de transition, avant de devenir un adulte lobé (Figure 2).
Programme GELAMED – Étude du Plancton GELAtineux sur la façade MEDiterranéenne
Mnemiopsis était l’une des espèces ciblées dans le cadre du programme GELAMED – Étude du plancton GELAtineux sur la façade MEDiterranéenne (Financement Liteau – Fondation Total – 2010-2012). Cette étude a permis, entre autres, de faire une mise à jour de sa distribution biogéographique sur nos côtes, d’étudier la dynamique de sa population et d’identifier les facteurs environnementaux la contrôlant.
Pour ce faire, un suivi bimensuel a été réalisé pendant deux ans (2010 et 2011) dans les lagunes de Bages-Sigean, Thau et Berre, ainsi qu’au niveau de deux stations côtières adjacentes (Sète et Marseille). Différents paramètres environnementaux ont été analysés : température, salinité, abondances phyto- et zooplanctoniques. Alors que les deux autres lagunes ont été suivies tout au long de l’année, l’Étang de Bages-Sigean n’a été échantillonné qu’entre mai et septembre 2010 et entre juin et novembre 2011 lorsque la présence de zooplancton gélatineux était observée par les pêcheurs locaux.
Prélevés par des traits de filet horizontaux, les individus de Mnemiopsis ont ensuite été comptés et mesurés pour chaque date et station de prélèvements.
Comment expliquer le succès invasif de Mnemiopsis ?
Bien qu’elles présentent des conditions environnementales très variables, les lagunes constituent un environnement privilégié pour l’établissement de populations durables de Mnemiopsis. Les milieux sous forte pression anthropique sont ainsi beaucoup plus sensibles aux introductions d’espèces invasives. Durant notre étude, Mnemiopsis a été observé uniquement dans les lagunes de Berre et de Bages-Sigean dont la salinité est plus basse (23 et 26 respectivement) que dans l’Étang de Thau (36). L’Étang de Berre présente une population pérenne, avec une dominance de larves en hiver (décembre à février). Les adultes étaient particulièrement abondants à la fin de l’été (août-septembre) dans les deux lagunes, lorsque les températures étaient les plus chaudes et la salinité supérieure à 15. Les proliférations de Mnemiopsis sont principalement observées dans des milieux très productifs tels que Berre et Bages-Sigean, qui présentent tous deux de fortes abondances planctoniques. Ce prédateur extrêmement vorace est en effet capable d’ingérer 10 fois son poids humide par jour (Kremer 1979).
Mnemiopsis atteint des abondances plus élevées dans l’Étang de Bages-Sigean (115 ind m-3) que dans l’Étang de Berre (24 ind m-3). Ces abondances s’avèrent néanmoins être nettement inférieures à celles observées dans son milieu d’origine (1 450 ind m-3 dans la Baie de Narragansett, Nord-Est des États-Unis, Costello et al. 2006). Par ailleurs, les plus grands individus ont été observés dans l’Étang de Berre avec un maximum de 6 cm (avril 2010) contre 4,2 cm dans l’Étang de Bages-Sigean (août 2010).
Des analyses statistiques ont été réalisées afin d’établir un lien entre un ou plusieurs facteurs environnementaux (température, salinité, concentration en chlorophylle et abondance en zooplancton) et la dynamique de population de Mnemiopsis. Alors que la distribution du spectre de taille ne semble pas dépendre d’un facteur particulier, l’abondance apparaît être principalement liée aux variations de salinité et de température.
D’autre part, l’absence de ses prédateurs connus (cténophores (Beroe sp.), méduses (Pelagia noctiluca) et certains poissons …) dans les milieux où il est introduit favorise le développement de fortes populations.
Son absence aux stations de Marseille (zone côtière adjacente à l’Étang de Berre) et de Port-la-Nouvelle (située dans le canal connectant l’Étang de Bages-Sigean à la mer) nous incite à penser qu’il n’est pas advecté depuis ou vers les zones côtières, mais qu’il réalise la totalité de son cycle de vie dans ces deux lagunes. Le fait qu’il ne soit pas détecté par les pêcheurs dans l’Étang de Bages-Sigean en hiver peut être expliqué par l’existence de zones refuges (embouchure de rivières notamment) où il passerait la saison froide dans des conditions environnementales plus clémentes permettant sa survie.
L’absence de Mnemiopsis dans l’Étang de Thau, situé à mi-distance entre les deux autres lagunes, reste très surprenante. En effet, le port de Sète, tout comme ceux de Marseille et de Port-la-Nouvelle, est le lieu d’un important trafic maritime favorisant l’introduction d’espèces par les eaux de ballast. De plus, cette lagune présente des conditions environnementales théoriquement favorables à l’installation d’une population viable de Mnemiopsis. Une de nos hypothèses est l’observation d’une communauté zooplanctonique plus diversifiée dans cette lagune qui ne laisserait pas de niche écologique disponible pour l’établissement du cténophore.
Mnemiopsis : une menace pour nos lagunes ?
Les trois lagunes étudiées ici étant exploitées par l’Homme, le développement d’une telle espèce pourrait constituer une menace sérieuse pour ces milieux déjà fragilisés. En effet, les proliférations de Mnemiopsis peuvent créer un profond bouleversement du réseau trophique, avec un épuisement du stock de zooplancton en quelques heures à quelques jours. Cela induit une prédation potentiellement massive des œufs et larves de poissons, ainsi qu’une compétition alimentaire directe. Ainsi, sa présence en Mer Noire a empêché le renouvellement des stocks de poissons, ces derniers ayant déjà été largement altérés par la surpêche, l’eutrophisation et la pollution (Purcell et al. 2001). Les pêcheries traditionnelles exercées dans les lagunes de Berre et de Bages-Sigean seraient donc impactées, notamment celles des anguilles. Le colmatage des capéchades par une forte biomasse gélatineuse (Figure 3) endommage les anguilles et les tue par suffocation, ce qui les rend impropre à la vente.
De même, l’introduction de Mnemiopsis dans l’Étang de Thau pourrait avoir de lourdes conséquences économiques, cette lagune représentant 70 % de la production conchylicole méditerranéenne française (Gervasoni et al. 2011).
Dans ce contexte, deux des lagunes suivies lors du programme GELAMED restent sous surveillance : l’Étang de Thau afin de suivre l’éventuelle apparition de Mnemiopsis et l’Étang de Berre afin d’observer l’évolution de la population qui y est implantée.

- Contacts
Delphine Bonnet – Responsable du programme GELAMED (04 67 14 47 63 – [email protected] [1])
Floriane Delpy (04 94 14 67 46 – [email protected] [2])
Références bibliographiques :